
FDA今天向Fontem US发布了一项营销拒绝令 (MDO),适用其Myblu换弹设备和多种口味。
Myblu的PMTA被拒绝是第一个宣布的MDO,该MDO是针对一家大型烟草公司生产的基于换弹的产品发布的。
Myblu由Fontem US制造和销售,Fontem US是Imperial Brands(帝国品牌)的电子烟产品部门,该公司是一家市值超过 200 亿美元的大型国际烟草公司。
今天的决定是对市场第四名的裁决,Myblu不幸被拒绝。
根据尼尔森对便利店零售数据的最新分析,在涵盖了截至3月26日的四个星期内,确定Juul市场份额为35.7%,Vuse市场份额为33.9%,NJoy为3.2%,Fontem Ventures的blu eCigs为2.3%。
这一拒绝意义重大。

Myblu被拒绝可能表明FDA也将拒绝其他基于换弹的产品,可能是因为它们的尼古丁输送比老一代 Vuse Solo和已获得营销授权的两种Logic电子烟产品更有效。
FDA在声明中表示,拒绝的理由包括Fontem的Myblu申请缺乏「关于设计特征、制造和稳定性的足够证据」。如果没有看到实际的拒绝令,没有人可以确定这意味着什么,但它几乎可能涉及与设备、烟弹或电子烟油的性能或物理结构相关的任何事情。
此外,FDA还表示,这些申请并没有证明完全或显著减少吸烟的吸烟者的潜在好处会超过对年轻人的风险。
这句话的意思是,如果放行此类产品申请,得到的坏处会比好处更多,也就是年轻人使用电子烟的风险收益超过给成年烟民带来的减少吸烟可能。
收到营销拒绝令的Myblu产品如下:
FDA还为一些目前尚未上市的Myblu烟弹发布了MDO,因此未在FDA公开的 PMTA 提交清单中列出。
Fontem尚未宣布其在2020年4月的Myblu PMTA中包含哪些额外口味,但当时表示提交的范围广泛。
其他Blu产品,包括Blu的一次性cigalikes和可充电PLUS+ cigalikes,仍在接受 FDA审查。
奇怪的是,两个薄荷醇Myblu烟弹仍在审查中,但如果没有已经被拒绝的电子烟设备,它们将完全没用。
按照FDA的规定,Fontem必须立即停止销售产品,否则将面临可能的执法行动。
该公司现在有30天的时间向Myblu的MDO提出法律挑战。
目前,30多家小型独立电子烟公司已在联邦法院对其MDO提出质疑,其他公司已向FDA提出行政上诉,这也是Fontem的一种选择。
一些制造商已收到拒绝令,而FDA被迫撤销其他一些制造商的MDO。
我们预计Fontem会发起挑战,毕竟是美国市场第四名。
在审查烟草制品的上市前申请时,FDA评估这些烟草制品对整个人群(包括烟草制品的使用者和非使用者)的风险和益处,除其他事项外,还考虑那些不这样做的人的可能性。
根据Fontem US, LLC 为这些myblu产品提交的申请中提供的信息和现有证据,这些申请在设计特征、制造和稳定性方面缺乏足够的证据。
此外,这些申请并没有证明完全或显著减少吸烟的吸烟者的潜在好处会超过对青少年的风险。
因上市前提交而受到负面行动的烟草产品,包括受MDO约束的烟草产品,不得在美国销售、分销或营销。此类产品不得引入或交付用于引入州际贸易,如果该产品已经投放市场,则该产品必须从市场上撤出。
目前,FDA的最高执法优先事项是未申请的电子烟产品,包括例如具有MDO或未提交申请的产品。
FDA认为,今天的行动使FDA朝着确保所有被认定的新烟草产品在合法上市之前都经过科学审查并获得FDA上市许可的目标又迈进了一步。
在2020年9月9日截止日期前提交申请的近670万种产品中,FDA已完成对 99%以上的审查并做出决定。
其实,全球电子烟从业者目前非常关注两个类别的PMTA申请。
第一类别是美国市场前三名的命运将如何,Juul、Vuse和Njoy的结果将影响美国电子烟市场,目前Myblu的换弹系列全军覆没,让人对换弹系列担忧。
第二类别是和中国公司有关的PMTA申请,这些申请可能涵盖开放式烟具、换弹设备和烟油。
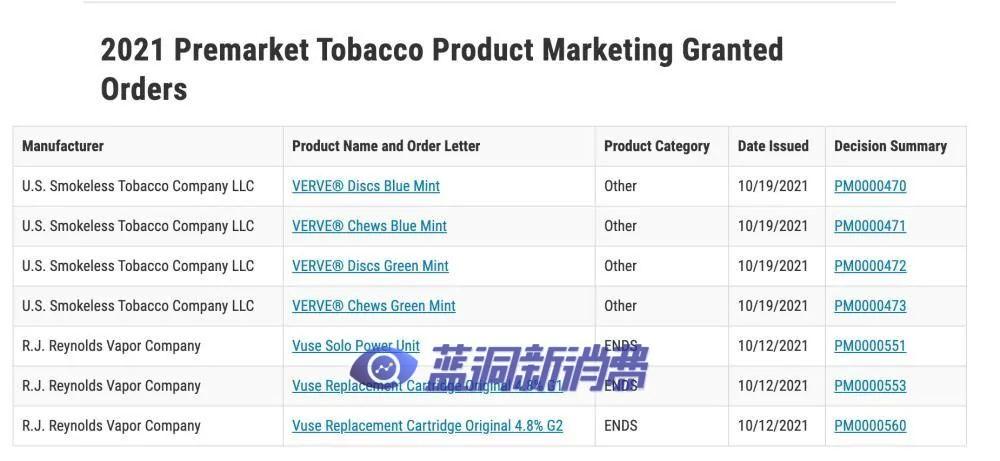
目前只有两家公司的电子烟产品获得了PMTA在美国销售资格。
3月25日,FDA授权销售由日本烟草国际 (JTI) 的电子烟产品部门Logic Technology Development LLC 生产的两种电子烟设备和烟草味补充装等8款产品通过审核,同时还向Logic发布了多种其他产品的营销拒绝令。
这些是自英美烟草旗下Vuse Solo于2021年10月成为第一款电子烟产品以来,该机构唯一授权的电子烟产品。
Logic是第二家获得FDA批准销售的电子烟产品的公司。
2021年10月,英美烟草旗下RJ Reynolds (RJR) Vapor Company所属的Vuse Solo 设备和两个烟草味烟弹三种过时的蒸汽产品获得了营销许可,烟草口味以外的调味均被拒绝。
一个背景资料补充。
现任FDA局长 罗伯特·卡利夫和卫生与公众服务部部长泽维尔·贝塞拉 都对电子烟持怀疑态度和敌对态度。 近年来,双方都主张彻底禁止调味产品。
所以,美国电子烟市场的苦日子还在后面。
此外,蓝洞查阅了这两个公司获得通过的产品照片,发现了其中共性。
Vuse Solo

Logic PRO

VAPE LEAF
啥共性?复古、难看、性冷淡。

再看看被拒绝的Myblu换弹设备。最终的结论是什么?那就是:
长得好看的都被拒绝了!长得难看的都审核通过了!
大概是因为设计越难看越性冷淡,传送尼古丁效率越低的产品,越不容易吸引未成年人使用!
离谱。









